발리후의 원개발의약품【레비트라(Levitra)】에 관하여
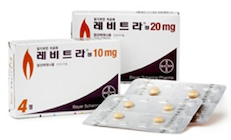
- 상품명
- 레비트라(Levitra)
- 주성분
- 바데나필염산염(Vardenafil)
- 성상
- 연한 오렌지색-회색을 띤 오렌지색의 원형 필름코팅정
- 제조(수입)업체명
- 바이엘코리아
- 판매명
레비트라®정 10mg(1회량:1정)
레비트라®정 20mg(1회량:1정또는 반정)- 복용횟수
- 1일1회
효능및 효과
- • 레비트라는 발리후와 같은 유효 성분 (바데나필염산염)을 함유 한 ED 치료약 (발기 부전 치료제)입니다.
- • 레비트라의 효능은 음경 해면체 평활근을 이완시켜 해면체동에 혈액량을 증가하여 음경의 발기를 재촉합니다.
처방대상
처방대상은 하기의 증상에 해당되시는 분입니다.
- 자력으로 충분한 발기를 얻지 못하고 성행위를 만족하게 할 수없는 사람.
- 상기의 이유로 의사로부터 ED (발기부전)로 진단되어 치료에 레비트라 처방이 필요한 분.
- 바이엘에 관하여(Wikipedia)
복용방법
- 성인 남성은 1일1회, 성행위 약1시간 전에 복용하십시요.
- 1 회 복용후 2회복용은 24시간후에 드셔야 합니다. 또한 20mg이상을 한 번에 복용하시면 절대로 안됩니다.(강한 부작용을 수반)
사용상 주의사항
- 성행위를 할 경우 심장에 대한 위험성이 있기 때문에 발기부전 치료를 시작하기 전에 환자의 심혈관상태를 충분히 확인해야 한다. 이 약을 포함한 발기부전 치료제는 심혈관계 기저질환 등으로 인하여 성행위가 권장되지 않는 환자에게는 일반적으로 사용하지 않는다.
- 이 약의 혈관확장 경향으로 인한 경증 및 일과성 혈압저하가 나타날 수도 있다. 좌심실유출폐색(예: 대동맥 협착증 및 특발성 비후성 대동맥판 하부 협착증)이 있는 환자는 PDE5 저해제를 포함한 혈관확장제의 작용에 민감할 수 있다.
- 4시간 이상의 지속된 발기 및 지속발기증(6시간 이상의 통증을 수반한 발기)이 드물게 보고되었다. 4시간 이상 발기가 지속될 경우 즉시 의사의 도움을 받아야하며, 지속발기증을 곧바로 치료하지 않으면 음경 조직손상 및 발기력의 영구상실이 야기될 수 있다.
- 투여하기 전이나 투여하는 동안 및 투여한 후 모든 형태의 질산염 제제 또는 NO 공여제 (니트로글리세린, 아밀나이트레이트, 질산이소소르비드)를 복용하는 경우 혈압강하작용이 증강되어 과도하게 혈압이 떨어질 수 있으므로 의사는 이 약을 처방하기 전에 환자가 질산염 제제 및 NO 공여제를 투여하지 않았는지 충분히 확인하여야 하며, 이 약 투여 중 및 투여 후 질산염 제제 및 NO 공여제를 투여하지 않도록 주의시킨다. 복용하지 말아야 할 분
복용하지 말아야 할 분
- 이 약 또는 이 약의 성분에 과민증이 있는 환자
- 질산염 제제 또는 산화질소(NO) 공여제(니트로글리세린, 아밀나이트레이트, 질산이소소르비드 등)를 정기적으로 또는 간헐적으로 복용하는 환자 (혈압강하작용이 과도하게 증강될 수 있음)
- 중증 간부전 환자 (Child-Pugh C)
- 투석이 필요한 말기 신장질환자
- 저혈압 환자 (휴지기 혈압 90/50mmHg 미만)
- 최근 6개월 내에 뇌졸중 또는 심근경색이 있었던 환자
- 성행위가 권장되지 않는 남성(예, 불안정형 협심증 또는 중증 심부전 [NYHA III 또는 IV] 같은 중증 심혈관질환자)
- 이미 알려진 유전적인 퇴행성 망막질환자 (예: 색소성 망막염)
- 이전의 PDE5 저해제 복용 여부와 관계없이 비동맥전방허혈성시신경증(Non-arteritic anterior ischemicoptic neuropathy, NAION)으로 인해 한쪽 눈의 시력이 손실된 환자
- 다른 발기부전 치료제를 복용 중인 환자 (다른 발기부전 치료제와 병용 투여한 연구가 없으므로 다른 발기부전 치료제와 함께 병용투여하지 말 것)
- 강력한 CYP3A4 저해제로서 HIV 프로테아제 저해제인 인디나빌 또는 리토나비어를 투여 받는 환자
- 75세 이상의 노인으로서 강력한 CYP3A4저해제인 이트라코나졸 및 케토코나졸을 투여 받는 환자
- 18세 미만의 청소년
- 수용성 구아닐산 고리화 효소(sGC) 자극제인 리오시구앗을 투여 받고 있는 환자
레비트라의 역사
100년 전통의 아스피린 역사를 가진 바이엘사가 연구개발한 레비트라는2001년11월 바이엘사와 글락소 스미스클라인사가 서명한 전세계적 공동판촉 및 공동개발 계약에 따라 판매되기 시작했으며, 2005년 1월부터는 바이엘사가 단독 판매하고 있다.
레비트라는 제출된 품질, 안전성, 그리고 유효성 데이터에 근거하여 2003년 3월 6일 유럽위원회의 승인을 받았으며, 이들 데이터는 폭 넓은 환자 집단을 대표하는 3,750명 이상의 남성들을 대상으로 한 연구 결과들을 포함하고 있다.
한국은 2003년 8월 19일 KFDA(Korea Food & Drug Administration: 한국 식품의약품안전청)로부터 허가를 받아2003년 10월1일부터 시판되고 있다.
한국 KFDA에서 수입허가를 받은 레비트라는 2003년 8월, 미국 FDA에서도 판매승인을 받았다. 이는 비아그라 이후 5년 만에 처음으로 출시된 새로운 경구용 발기부전 치료제로 기록된다.
레비트라는 미국 출시 채1개월도 안돼 발기부전 시장에서 신규 처방 50%를 점유했다. (2003/9/18 제약홍보연구회사 ImpactRx 발표)
이는 레비트라가 단순 발기뿐만 아니라 만족할 수 있는 성관계의 질과 지속시간을 개선하고자 하는 남성에게 효과를 보인 것으로 분석됐다.